导读:免疫检查点抑制剂单药用于术前诱导治疗已经有众多研究,主要病理学缓解(MPR)在20%~45%之间。晚期患者中,放疗与免疫治疗显示了良好的协同作用,在新辅助治疗阶段,放疗与免疫联合治疗是否可以提高疗效呢?近期,Lancet Oncology杂志发表了一项随机对照研究,结果显示,在Durvalumab治疗的基础上进一步联合小剂量放疗,可以将患者的MPR由6.7%提高至53.3%,提高了接近10倍。
以免疫检查点抑制剂为基础的新辅助治疗是可手术非小细胞肺癌术前诱导的重要治疗选择。在一个单臂队列研究中,22例接受Nivolumab单药诱导治疗的患者,主要病理学缓解率(MPR)达到45%。但后续的研究中,多数研究发现,单药免疫检查点抑制剂术前诱导治疗的MPR在14%~20%。在一项前瞻性研究中,研究者纳入Ib-IIIa期NSCLC患者接受Atezolizumab单药治疗。在首先入组的101例患者中,MPR为18%。NEOSTAR研究中,Nivolumab单药组的MPR率为22%。2020年,研究者公布了PRINCEPS研究的初步数据,Atezolizumab单药的MPR为14%,而在IONESCO研究中,Durvalumab单药的MPR为18%。而以此为基础的联合治疗,可进一步提高免疫检查点抑制剂的疗效,在一项小型II期临床研究中,免疫检查点抑制剂联合化疗的MPR达到85%左右。在晚期肺癌患者中,放疗可通过多种途径,包括诱导免疫细胞释放新抗原、上调MHC的表达等,与免疫检查点抑制剂发挥协同效应。本研究旨在探索Durvalumab联合小剂量放疗(8Gy,3次)术前诱导可手术患者的疗效及安全性。
这是一项单中心、开放标签的随机对照II期临床研究,比较Durvalumab单药,或在此基础上联合SBRT在1~3a期非小细胞肺癌患者中的疗效及安全性。研究纳入年龄≥18周岁的患者且无论PD-L1表达水平均可入组。符合入组标准的患者,按照1:1的比例接受Durvalumab单药或在此基础上联合SBRT治疗,患者入组前需接受 CT、PET及脑核磁检查,对全身状况进行评估。如果CT或PET显示非N2,不强制患者接受纵膈镜检查。符合入组标准的患者接受Durvalumab单药或联合放疗,放疗在第一周期与Durvalumab同时进行。接受手术的患者,接受常规放化疗,Durvalumab术后治疗时间不超过12个月。研究的主要终点为MPR,次要研究终点为两年DFS率。
从2017年1月至2020年9月,共计96例患者接受筛选,60例患者入组,两组均有30例患者,基线特点均衡可比(除PD-L1表达水平外)。所有患者均至少接受一次Durvalumab单抗治疗,联合组患者至少接受一次放射治疗。
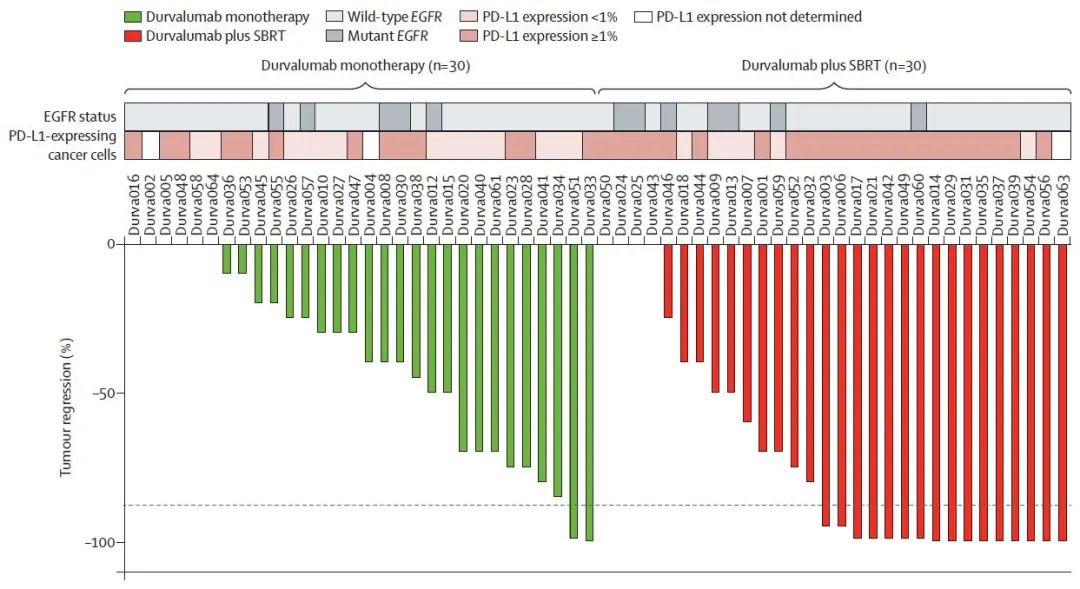
结果显示,两组MPR分别为6.7%和53.3%。联合治疗组中,16例评估为MPR的患者,8例评估为完全病理学缓解,差异具有统计学意义,OR=16。从组织病理学类型来看,单药组有两例患者评估为 MPR,均为鳞癌患者。联合治疗组18例腺癌和12例鳞癌患者中,均有8例患者评估为MPR(图1)。
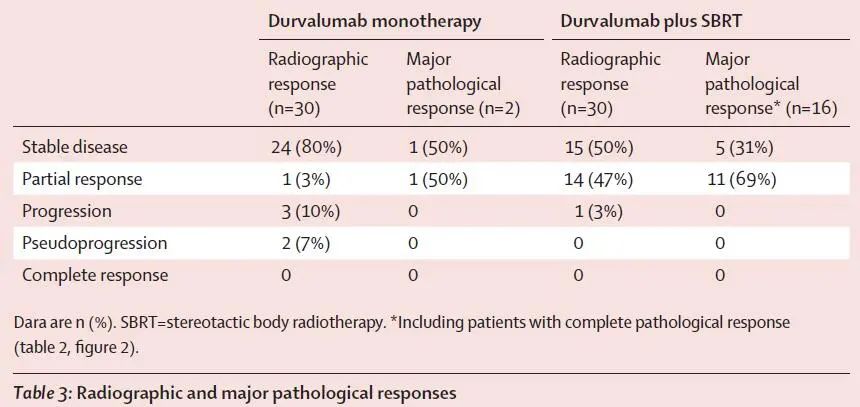
研究中,基于影像学评估和基于病理学评估展现了较大的差异性。基于影像学评估,两组的 CR率分别为0%和3.3%,单药治疗组,2例评估为MPR的患者,影像学评估1例为SD,1例评估为 PR;联合治疗组16例评估为MPR的患者,影像学评估11例为 PR,5例评估为SD(图2)。
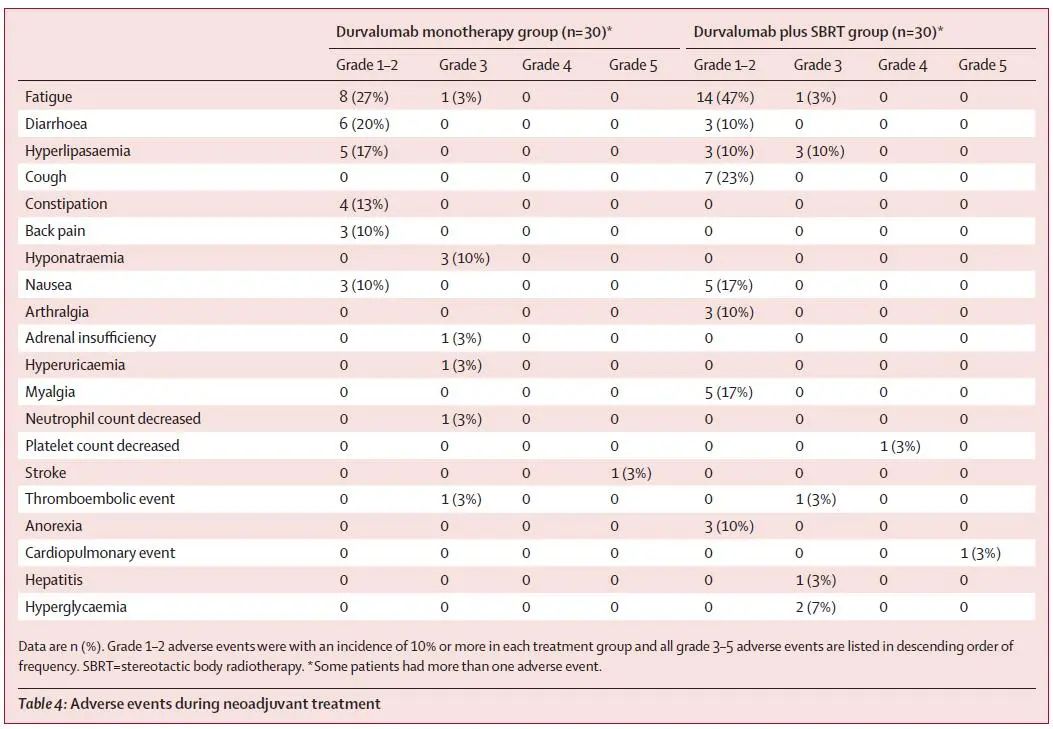
安全性:两组3度及以上不良反应发生率分别为17%和20%。最常见的不良反应均为低钠血症,发生率均为10%,两组严重不良反应发生率均为7%(图3)。
两组中位至手术时间分别为5.3周和5.4周。两组均有13%的患者接受治疗后未接受手术,接受手术治疗的患者,R0切除率分别为77%和83%。经过中位16.9个月的随访后,整个队列中,15%的R0切除患者出现复发,13%出现在单药治疗组。在单药治疗组,7例术前评估为N2的患者,仅有1例降期为N0。而在联合治疗组,6例评估为N2的患者,4例将期到N0。
新辅助Durvalumab联合SBRT耐受性良好,与较高的MPR有关,新的治疗策略需要进一步在大型临床研究中验证。
在晚期肺癌患者中,免疫治疗联合小剂量放疗展现了良好的协同效应。在Pembrolizumab-RT研究中,联合放疗可将患者的ORR由18%提高至36%,而中位PFS由1.9个月提高至6.6个月。这项研究是第一个证实免疫联合放疗可以提高患者MPR的随机对照研究。
在新辅助治疗领域,无论是免疫单药还是联合治疗,存在几个共同的问题:
首先,MPR与OS之间是否具有相关性。在化疗时代,由于完全病理学缓解率出现比例较低,因此,退而求其次的以MPR作为主要研究终点,但是在免疫治疗领域,MPR与OS之间是否存在相关性目前缺乏数据支持;
其次,对于病理评估为完全病理学缓解的患者,意味着患者已经不存在残存的肿瘤细胞,这种情况下是否需要继续给予术后辅助治疗有待于进一步研究;
最后,影像学评估和病理学评估存在较大差异。包括在NADIM研究中,约30%评估为SD的患者病理学评估为P-CR,而70%的评估为PR的患者,病理学评估为P-CR。甚至小部分影像学评估为PD的患者,其病理学评估也是P-CR。因此,如何避免病理评估和影像评估之间存在的差异对临床诊疗策略带来的影响,尤其是对于影像学评估SD或PD,而病理学实际是P-CR的患者,值得进一步探索。
目前,这一领域的研究与晚期肺癌患者的III期临床研究的样本含量存在较大的差异,即使是随机对照研究,其样本含量也基本在100例以内,考虑到这部分患者入组的难度及研究的随访时长,如何基于相对较小样本量的研究给临床带来有意义的探索,同样值得深思。
参考文献:Altorki NK et al. Lancet Oncol. 2021 May 17:S1470-2045(21)00149-2.DOI:10.1016/S1470-2045(21)00149-2.文献来源:https://linkinghub.elsevier.com/retrieve/pii/S1470-2045(21)00149-2 




 京公网安备 11010502033352号
京公网安备 11010502033352号