编者按:从固有免疫到特异性免疫,从以免疫细胞类型为导向到对免疫检查点的特异性抑制,历经近半个世纪沉浮,免疫治疗成为了肿瘤治疗领域的一场革新。但乳腺癌作为TMB较低的瘤种,一直被视为免疫治疗的荒漠,尽管如此,学者们对其在该领域进行的探索从未停止。?
免疫治疗一线应用初探,云深不知何处去
2018年10月,IMpassion 130研究证实PD-L1抑制剂Atezolizumab联合白蛋白紫杉醇(Nab-P)一线治疗晚期三阴性乳腺癌(TNBC),显著延长无进展生存期和PD-L1阳性患者的总生存期,推开了免疫检查点抑制剂(ICIs)在乳腺癌临床应用的大门。今年ESMO会议继续报道了IMpassion 130最终的OS结果,Atezolizumab延长PD-L1阳性患者中位OS达7.5个月,夯实了其在PD-L1阳性晚期TNBC治疗的一线地位。
免疫微环境与治疗反应息息相关,将免疫治疗前移至免疫状态更佳的新辅助阶段成为探索热点。Keynote-522犹如破晓的利刃,为TNBC新辅助免疫治疗带来曙光,然而NeoTRIPaPDL1研究却遭遇滑铁卢,Nab-P/卡铂联合Atezolizumab并未提高ITT人群的pCR(43.5% VS 40.8%,P=0.66),再次为免疫新辅助初探蒙上一层迷雾。
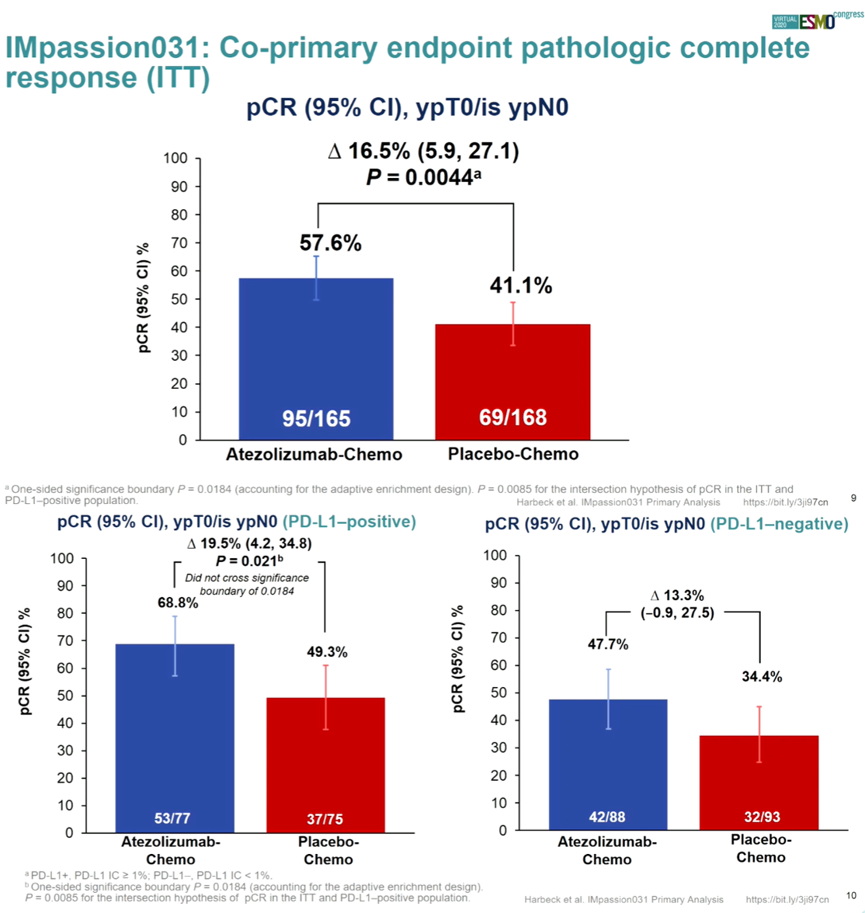
峰回路转,2020年ESMO会议IMpassion031研究结果重磅出世,力证Atezolizumab在TNBC新辅助治疗中的优势。该研究是一项多中心、随机、双盲的Ⅲ期临床研究,旨在评估Atezolizumab联合化疗在TNBC新辅助治疗中的疗效和安全性。入组年龄≥18岁、肿瘤>2cm、经病理证实为侵袭性Ⅱ-Ⅲ期且未经治疗的TNBC患者共333例,将其按照1:1进行随机分组。实验组接受12周Atezolizumab(840mg,IV,q2w)联合Nab-P(125mg/m2,IV,qw),序贯8周Atezolizumab(840mg,IV,q2w)联合多柔比星(60mg/m2,IV,q2w)+环磷酰胺(600mg/m2,IV,q2w);对照组接受12周安慰剂联合Nab-P(125mg/m2,IV,qw),序贯8周安慰剂联合多柔比星(60mg/m2,IV,q2w)+环磷酰胺(600mg/m2,IV,q2w)。随后所有患者进行手术,并对病理完全缓解进行评估,按照乳腺癌临床分期和肿瘤浸润免疫细胞PD-L1表达(IC≥1%VS<1%)进行分层分析。主要研究终点为ITT或PD-L1阳性(IC≥1%)患者pCR率,次要研究终点包括总生存期、无事件生存期、无病生存期和生活质量指标。预设单侧P<0.0184有统计学意义。

Atezolizumab与安慰剂组中位随访时间分别为20.6个月和19.8个月,ITT人群中Atezolizumab组pCR率提高16.5%(57.6% VS 41.1%,P=0.0044),PD-L1阳性患者pCR率提高19.5%(68.8% VS 49.3%,P=0.021)。安全性方面,新辅助治疗期间,Atezolizumab组与安慰剂组治疗相关3-4级不良反应发生率分别为56.7%和53.3%。Atezolizumab显著提高了TNBC患者pCR率,与PD-L1表达无关,且安全性良好。
纵观目前几项免疫治疗的新辅助研究,PD-1抑制剂Pembolizumab通过之前的Keynote-173研究和I-SPY2研究小试牛刀,被FDA批准用于高危早期TNBC新辅助治疗。在Keynote-522研究中,Pembrolizumab联合化疗显著提高了TNBC患者的pCR(64.8% VS 51.2%,P=0.00055)。而PD-L1抑制剂Atezolizumab却在IMpassion031和NeoTRIPaPDL1研究取得截然相反的结果。
为何同为ICIs在TNBC新辅助阶段的作用,结果却不尽相同?这对未来免疫治疗在TNBC新辅助中的应用有何启示??
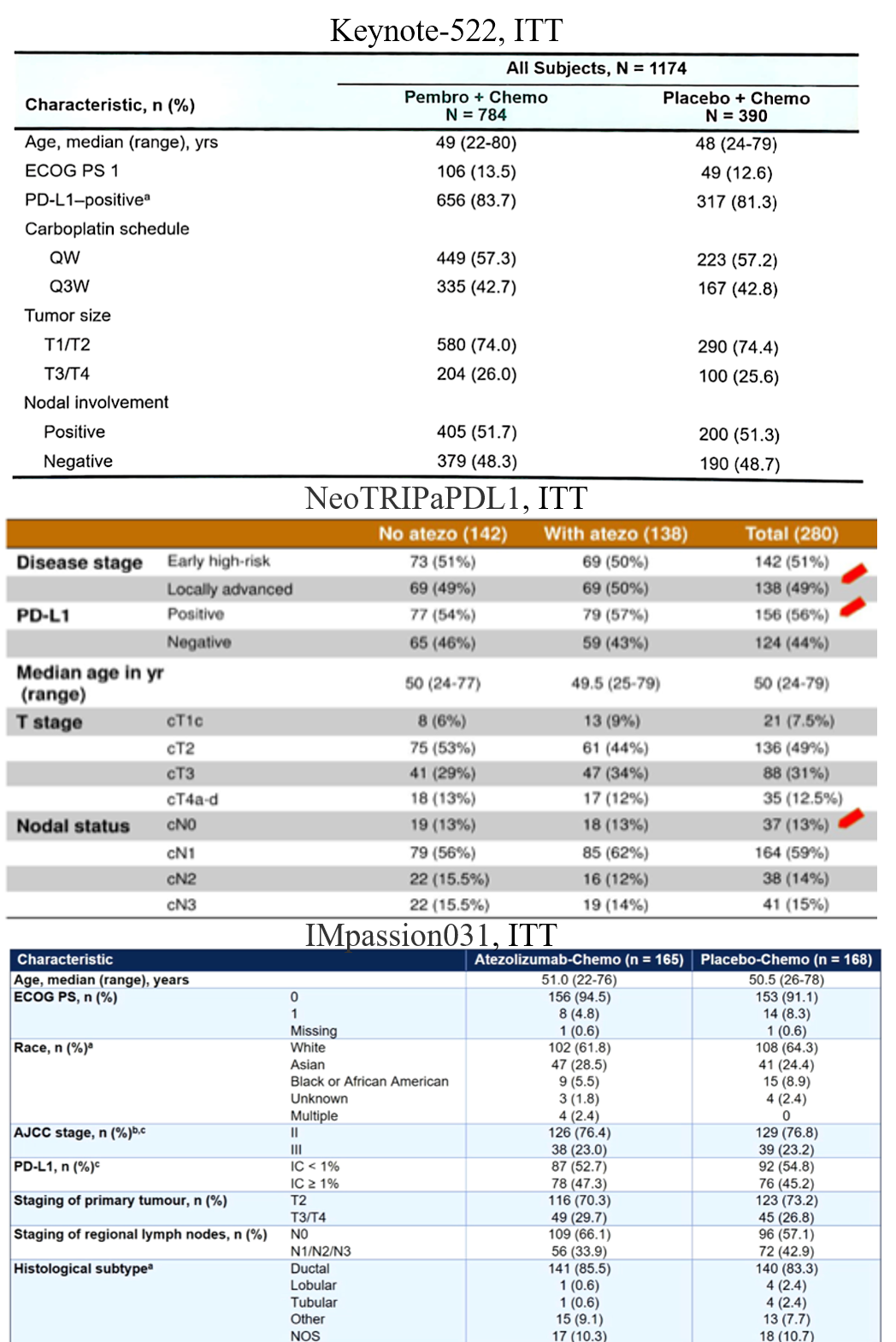
一、入组人群临床病理特征。NeoTRIPaPDL1研究入组的N0患者比例较低,仅为13%,T3/4比例较高,达46%;而IMpassion 031研究中N0患者比例为61.6%,T3/4比例29.7%;Keynote-522中N0患者比例48.3%,T3/4比例26%。从临床特征看,似乎肿瘤负荷低的患者更能从免疫治疗中获益,这可能与肿瘤早期对免疫微环境影响弱、局部晚期患者机体免疫状态相对低下有关。未来仍需要探索疗效预测的分子标志物以筛选免疫治疗的获益人群。
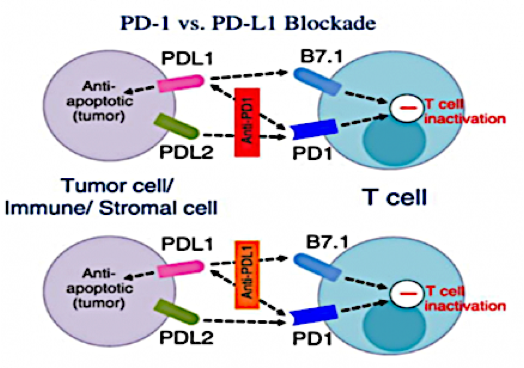
二、ICIs种类。目前应用的两类ICIs作用机制有所不同。PD-1抑制剂能特异性结合T细胞表面的PD-1蛋白,阻断其与癌细胞表面PD-L1结合,使T细胞正常发挥特异性免疫,还可作用于另一内源性配体PD-L2(主要由抗原呈递细胞表达),从而规避免疫逃逸。PD-L1抑制剂,则直接结合PD-L1蛋白,使其无法逃避T细胞的免疫清除,却不能有效阻断PD-1/PD-L2下游通路。从机制角度而言,PD-1抑制剂或许比PD-L1抑制剂有更优的效果。但免疫检查点抑制也是柄双刃剑,PD-1与PD-L1均非单一细胞特有,PD-1更广泛表达于TILs、单核细胞、树突状细胞等多种免疫细胞表面。ICIs可能使其它免疫细胞产生过度免疫抑制或应答,导致失调,造成“免疫风暴”。2019年一项纳入125项临床试验的Meta分析表明,PD-1抑制剂高级别不良事件的发生率高于PD-L1抑制剂,亦有研究显示PD-1抑制剂肺炎发生率和严重程度均高于PD-L1抑制剂。故评估潜在风险人群、探寻免疫不良反应早期监测指标,是免疫治疗在新辅助阶段顺利开展的关键。
三、PD-L1检测。不同于非小细胞肺癌、结直肠癌等瘤种以MSI/MMR、PD-L1和TMB等指标预测ICIs疗效,目前乳腺癌临床研究的分层因素仍以单一的PD-L1表达为主。
NeoTRIPaPDL1和IMpassion031采用的是VENTANA PD-L1(SP142)检测(IC≥1%);而Keynote-522采用的是22C3 PharmdX检测,PD-L1阳性标准为综合阳性评分CPS(PD-L1阳性肿瘤细胞、淋巴细胞、巨噬的数量/肿瘤细胞总数×100)≥1。VENTANA SP142、SP263和22C3 PharmdX均是获FDA批准作为非小细胞肺癌PD-L1表达的检测手段。其中,SP263和22C3 PharmdX对肿瘤细胞的染色数量较为一致,而SP142染色肿瘤细胞数量相对较少。但在同一平台运行时,SP263和22C3 PharmdX在1%和50%等临界值的判定上仍存在显著差异。同时,不同研究对PD-L1阳性细胞的囊括范围不一致,这些细微差别无疑会累积为分层人群间的巨大差异,影响研究结果。因此,统一PD-L1检测手段与平台、使用相同的PD-L1阳性标准,是明确PD-L1表达与疗效相关性、促使ICIs在有效人群中精准应用的前提。
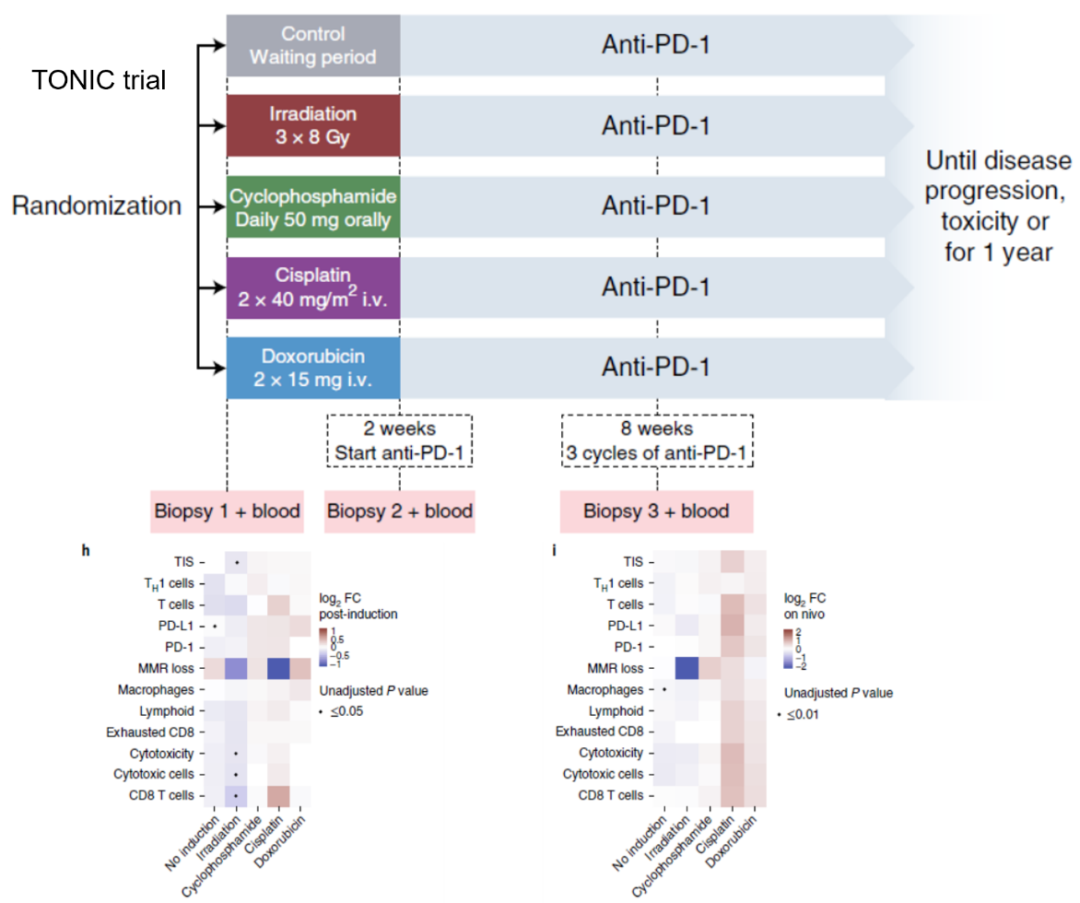
四、配伍方案。取得阳性结果的Keynote-522和IMpassion 031与阴性结果的NeoTRIPaPDL1相比,最显著的差异是有无联合含蒽环方案。蒽环类药物作为经典的强细胞毒性抗生素,不仅对肿瘤有直接的杀伤作用,还能诱导肿瘤细胞免疫原性死亡,激活树突状细胞的抗原呈递,增强CD8+T细胞增殖,同时选择性靶向作用于MDSC,解除肿瘤诱导的免疫抑制。在转移性乳腺癌的TONIC研究中,经多柔比星2周诱导后使用PD-1抑制剂Nivolumab可获得优于未诱导(17%)、放疗诱导(8%)、环磷酰胺诱导(8%)和顺铂诱导(23%)的最高ORR(35%),同时介导T细胞浸润,增强PD-L1表达和dMMR。dMMR常由DNA复制过程中的错配累积导致,或与蒽环类药物干扰DNA碱基配对与转录的细胞毒性机制有关。蒽环类药物在免疫治疗配伍中的价值值得进一步探究。

Keynote-522和NeoTRIPaPDL1研究方案均含有卡铂。铂类同为影响DNA化学结构的细胞毒药物,其在PD-1抑制剂Nivolumab应用后亦能增加CD8+T细胞等免疫细胞浸润、PD-L1表达以及dMMR的发生。但铂类最常见的不良反应之一为血液学毒性,卡铂引起粒细胞减少的发生率高达85%,贫血和血小板减少发生率分别为71.9%和62%。而以中性粒细胞为代表的三系细胞减少会通过周围循环系统降低机体固有免疫,影响肿瘤微环境的免疫水平。Keynote-522和NeoTRIPaPDL1研究中患者分别接受了4个和8个周期的卡铂治疗,治疗相关的血液毒性在NeoTRIPaPDL1中的发生率显著高于Keynote-522。是否多周期的卡铂应用导致血液毒性增加减弱了固有免疫水平,从而消弭了由卡铂本身介导的免疫诱导激活作用?在晚期TNBC的Keynote-355研究中,Pembrolizumab联合吉西他滨/卡铂并未提高PD-L1阳性亚组的PFS获益,铂类在免疫配伍中的作用仍待明确。
综上,IMpassion 031研究证实了Atezolizumab在TNBC新辅助治疗中的价值,而NeoTRIPaPDL1的阴性结果也为配伍方案等问题提供了细节的考量。ICIs的最佳配伍方案、使用时机,pCR与生存获益的关系,尚需进一步随访证实。另外,化疗、放疗等手段具有免疫刺激作用,可增加抗原摄取和提呈,增强抗肿瘤免疫应答。改变乳腺癌免疫原性,使“冷肿瘤”转变为“热肿瘤”,或可成为未来乳腺癌新辅助免疫治疗的新方向。免疫检查点抑制剂在TNBC新辅助治疗的探索之途已窥见天光。道虽迩,不行不至;行而不辍,则未来可期!
中国医科大学附属一院乳腺外科行政副主任
辽宁省特聘教授
中华医学会肿瘤学分会青委会副主任委员
中华医学会肿瘤学分会乳腺肿瘤青年学组主任委员
中国抗癌协会乳腺癌专业委员会青委会副主任委员
中国医师学会外科医师分会乳腺外科医师委员会青年委员
辽宁省抗癌协会临床细胞学专业委员会副主任委员
MD Anderson Cancer Center 访问学者
主持国家自然科学基金课题3项,省部级课题5项。荣获省部级科技进步奖5项,第九届辽宁青年科技奖。2018年入选辽宁省百千万人才工程“百”层次。
 ?
?
中国医科大学附属一院 乳腺外科 讲师
2020年毕业于中国医科大学获评“辽宁省优秀博士毕业生“
辽宁省医学会肿瘤学分会第十一届委员会青年委员会秘书