前言:目前已经有多款针对PD-1/PD-L1的免疫检查点抑制剂被批准与化疗联合,一线用于晚期非小细胞肺癌(NSCLC)患者。基于KeyNote-189研究的数据,Pembrolizumab是第一款被批准一线应用于NSCLC的药物,此外包括卡瑞丽珠单抗、替雷利珠单抗、信迪利单抗等针对PD-1的药物和阿替利珠单抗等针对PD-L1的免疫检查点抑制剂均在NSCLC领域进行了相关探索研究。近期,KeyNote-189研究公布了基于研究方案预先设定的OS分析。《肿瘤瞭望》对全文进行编译,欢迎各位读者交流讨论。

Pembrolizumab是一款针对PD-1的免疫检查点抑制剂,已被批准单药或联合化疗一线治疗EGFR/ALK融合阴性的晚期NSCLC患者。KeyNote-021G研究中,驱动基因阴性的晚期NSCLC患者,在含铂双药基础上进一步联合Pembrolizumab可以给患者带来获益。这一研究结果在KeyNote-189研究中被进一步证实,经过中位10.5个月的随访,联合治疗组的中位OS、PFS及ORR均优于单纯化疗组,经过额外10个月的随访后,患者获益仍然继续。本研究旨在更新方案预设的最终OS分析,并报道完成35周期治疗患者的长期随访数据。
KeyNote-189研究是一项随机对照研究,纳入组织病理学或细胞病理学确认的IV期非鳞癌、非小细胞肺癌患者,患者年龄≥18周岁,EGFR或ALK阴性,PS评分0~1分且有充足的组织标本进行PD-L1检测。稳定的脑转移患者允许入组。符合入组标准的患者按照2:1的比例随机分为Pembrolizumab组 (200mg,每三周一次)或单纯化疗组(培美曲赛500mg/m2,顺铂75mg/m2或卡铂AUC=5),免疫治疗上限35周期。经过4周期治疗后,允许接受培美曲赛维持治疗,直至疾病进展、出现不可耐受毒性反应或患者撤销知情同意。研究基于PD-L1表达水平、铂类药物选择及吸烟状态进行分层。患者疾病进展后,化疗组患者允许接受Pembrolizumab维持治疗。接受35周期治疗后,疾病未进展的患者,若疾病出现复发,允许第二次接受不超过17周期的Pembrolizumab治疗。研究前12周每6周进行一次疗效评估,随后每9周进行一次疗效评估。本研究主要终点为PFS和OS,次要研究终点为ORR、DOR及PFS2。
该研究共在118家研究中心纳入616例患者,联合免疫治疗组和单纯化疗组分别入组410例和206例患者,患者基线特点均衡可比。数据锁库时,全组患者中位随访时间31个月,两组分别有17例和1例患者继续接受研究药物治疗。中位治疗持续时间分别为7.2个月和4.2个月,13.7%的患者完成35周期治疗。化疗组有40.8%的患者疾病进展后交叉接受Pembrolizumab治疗,另有15%的患者接受其他针对PD-1或PD-L1的免疫检查点抑制剂治疗。
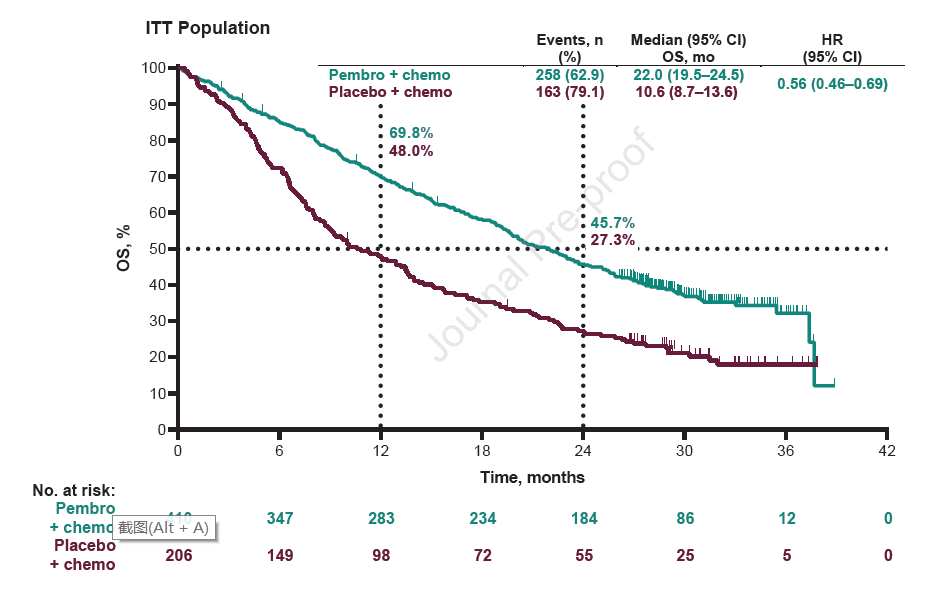
数据锁库时,两组分别有62.9%和79.1%的患者出现死亡事件。中位OS分别为22个月和10.6个月,HR=0.56,24个月的OS率分别为45.7%和27.3%,无论患者PD-L1表达水平,均可获益。PD-L1≥50%、1-49%和<1%的患者,HR分别为0.59、0.66和0.51(图1)。
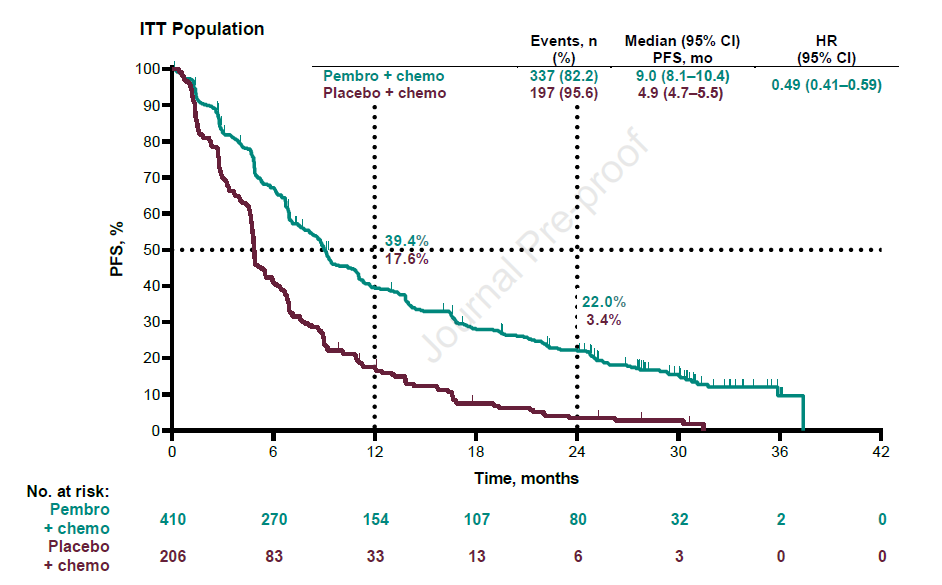
数据分析时,两组分别有82.2%和95.6%的患者出现疾病进展。中位PFS分别为9.0个月和4.9个月,HR=0.49,24个月的PFS率分别为22%和3.4%,无论患者PD-L1表达水平,均可获益。PD-L1≥50%、1-49%和<1%的患者,HR分别为0.35、0.53和0.67(图2)。
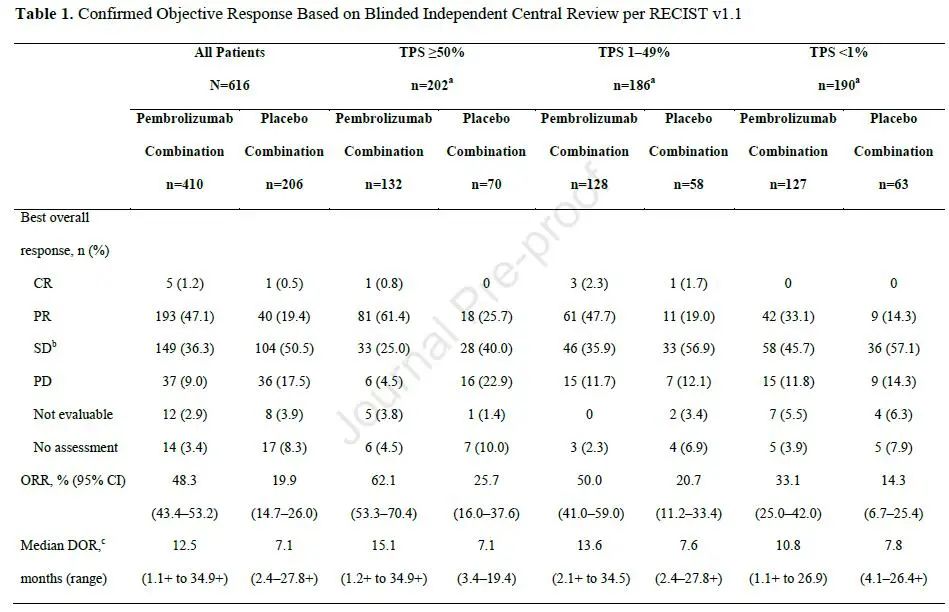
两组ORR分别为48.3%和19.9%,无论PD-L1表达水平,均可获益,中位响应持续时间分别为12.5个月和7.1个月,24个月的响应持续率分别为28.4%和9.9%。两组中位PFS2分别为17.0个月和9.0个月,24个月的PFS2率分别为38.2%和16.2%(图3)。
化疗组有84例患者疾病进展后接受Pembrolizumab治疗,其中28.6%的患者PD-L1≤1%,中位交叉时间为6.9个月,患者接受Pembrolizumab治疗后,中位PFS为2.8个月,24个月的PFS率12.1%。
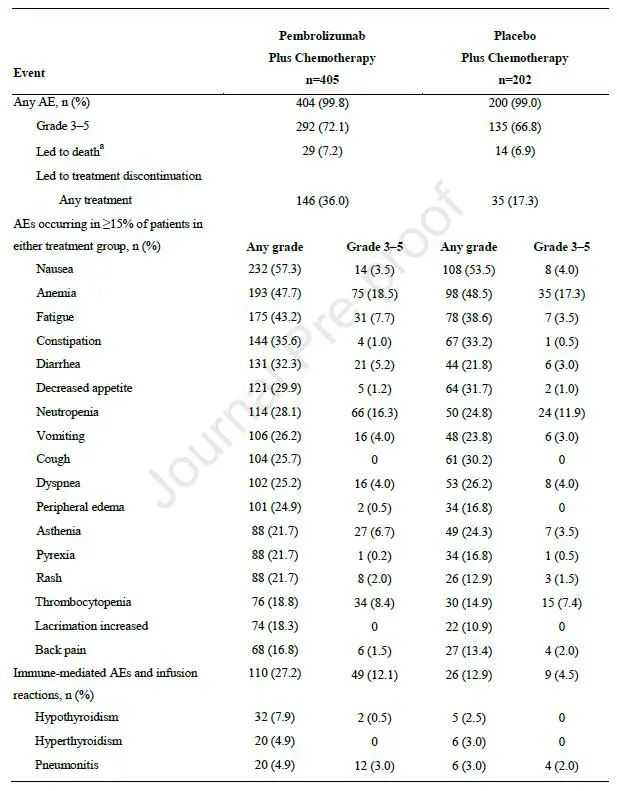
安全性:两组分别有99.8%和99.0%的患者出现全因任何级别不良反应,其中治疗相关不良反应发生率分别为92.8%和90.6%。3-5级全因不良反应发生率分别为72.1%和66.8%。两组分别有7.2%和6.9%的患者出现致死性不良反应。研究中,56例患者完成35周期治疗,基线特点和ITT人群相似,其中83.9%的患者PD-L1≥1%,ORR为85.7%,包括4例CR,44例PR及8例SD,中位响应持续时间为34.5个月,中位OS未达到。这部分患者中,3~4度不良反应发生率为60.7%(图4)。
Pembrolizumab联合铂类药物为基础的化疗,可以给晚期非小细胞肺癌患者带来持续获益且具有可管理的安全性。研究结果支持该治疗策略作为转移性非鳞癌、非小细胞肺癌患者的一线治疗。
参考文献:Rodríguez-Abreu D, et al. 2021:S0923-7534(21)01146-7.DOI:10.1016/j.annonc.2021.04.008.文献来源:https://pubmed.ncbi.nlm.nih.gov/33894335/ 




 京公网安备 11010502033352号
京公网安备 11010502033352号